Los conocimientos actuales sobre la fisiología reproductiva ha modificado sustancialmente los conceptos que existían sobre La regulación del ciclo estral, situación que se ha producido básicamente a causa del desarrollo de la biotecnología de la reproducción, principalmente la transferencia de embriones y la fecundación in vitro.
Las que han exigido de un conocimiento cabal de los procesos de tipo estructural y funcional de los órganos que constituyen el eje hipotálamo hipófisis ovario, además se ha profundizado también en los roles protagónicos del útero y el embrión, en todo este complejo proceso.
Por las razones antes señaladas se requiere actualizar la problemática relacionada con la dinámica folicular y su importancia en La regulación del ciclo estral, es por ello que se dedica una atención especial a este proceso así como lo relacionado con el funcionamiento del cuerpo lúteo y sus lisis.
Foliculogénesis
La cantidad de folículos primordiales está determinada en el momento de nacer cada hembra, de modo que se han planteado cantidades específicas para cada especie, por ejemplo se señala que en la especie bovina la cifra puede ser desde 130.000 hasta 175.000 según diferentes autores, en la porcina se reduce a 80.000, mientras que en la humana la cifra es de 400.000.
La comparación entre especies de mamíferos sugiere que no existe relación aparente entre la magnitud de la población de folículos primordiales y el subsiguiente tamaño de la camada o la duración de vida reproductiva del adulto.
Los folículos primordiales inician su crecimiento y diferenciación en un proceso aparente continuó Irreversible qué es conocido como foliculogénesis. Cuando un folículo entra en el grupo de crecimiento, este será conducido a uno de los dos hechos siguientes:
La degeneración por atresia, proceso que afecta a la casi totalidad de los folículos y finalmente concluir en el proceso de ovulación (ovocitación), de modo que algunos investigadores han sugerido que en el caso particular de la vaca, por cada ovulación se elimina más de 12 folículos a través de los procesos de atresia.
Los folículos en el proceso por el cual una cantidad de folículos, constante de cada especie, y los ovocitos que estos contienen, maduran en cada ciclo estral, frecuentemente un solo folículo madura y concluye en la ovulación de la vaca Durante cada ciclo estral, no obstante, las ovulaciones dobles o múltiples pueden ocurrir de manera natural.
El proceso de desarrollo de los folículos es de forma interrumpida y su duración se ha calculado en unos 180 días. La maduración folicular se adelanta a la maduración del ovocito (ovogénesis) de modo tal que cuando el folículo concluye su desarrollo folículo de graff aún el ovocito se encuentre un estadio de madurez.
El folículo primordial constituye la reserva ovárica y puede permanecer de modo indefinido en los ovarios, transformándose en folículo primario cuando es activado por su desarrollo, hasta el momento el folículo no es gonadotropodependiente, por tal razón Todavía no se ha precisado la naturaleza del estímulo que produce la activación del folículo para su desarrollo ulterior.
En este sentido se han sufrido diversas hipótesis, las que incluyen el aumento en la cantidad de las células precursoras de la teca interna, mecanismo inductor intrínseco de cada folículo y la localización de los folículos dentro de la zona cortical del ovario.
Células de la granulosa se transforma de aplanada a cuidar la teca interna comienza su diferenciación, al folículo en desarrollo se le denomina folículo primario. Su crecimiento hacia el siguiente estadio, qué es el folículo secundario, se completa por la proliferación de las células de la granulosa; los folículos en estos dos estadios se describen colectivamente como preantrales.
La ocurrencia del desarrollo durante la vida de los mamíferos y la relativa ausencia de atresia durante los estadios preantrales de la foliculogénesis sugiere que el control paracrino del desarrollo puede ser un proceso constitutivo en la granulosa, teca y células del estroma ovárico.
El siguiente estadios de desarrollo se caracteriza por la formación de una cavidad en el folículo y la producción de líquido, con el nombre genérico de folículos antrales. La tasa de crecimiento folicular es muy lenta en Los folículos antrales pequeños o temprano, necesitando más de dos semanas para alcanzar el diámetro de 0,3 mm. Sin embargo, crecimiento de los folículos antrales grandes rápido, su tasa más elevada parece ocurrir entre 1 y 2 mm de diámetro.
Generalmente se acepta que la formación del antro folicular en los mamíferos es un evento influenciado por las gonadotropinas y que la FSH en la principal hormona responsable.
Durante toda esta etapa la trama de transformación los folículos se encuentran bajo la influencia de las gonadotropinas FSH y LH, señalándose de modo reiterado la importancia de la FSH en la formación del antro folicular, lo cual se ha podido reproducir por medios experimentales.
En el folículo antral desean diferenciar estructura que cumplen una función importante de la liberación de los esteroides sexuales (estrógenos y andrógenos); estas estructuras conocidas clásicamente como membrana granulosa y teca interna tienen un comportamiento diferente a la acción gonadotropicas, es decir, la producción estrogenica es asumida solamente por las células de la granulosa bajo la influencia de la FSH.
Por eso receptores desarrollados en la fase de folículo antral, sin embargo la teca interna, que es una estructura muy vasicularizada, no tiene capacidad para producir estrógenos toda vez que en ella no se desarrollan receptores bioactivos para la FSH mientras que si tiene receptores LH. Por tal razón su producción esteroidea el androgénica, la que es transformada en estrógenos a nivel de la granulosa folicular.
Desde el punto evolutivo, y el ovocito se han producido también cambios estructurales, pues en este se han diferenciado una capa protectora de varias decenas de micras de grosor y constituidas por una mucoproteinas, que envuelve al ovocito, conocida como zona pelúcida.
Existe además una protección de tipo histológico estructurada por células foliculares, provenientes, posiblemente, de la granulosa, conocida comúnmente como Corona radiada. La zona pelúcida y la corona radiada desempeñan un rol importante en los procesos de penetración nemaspermica y defensa o bloqueos contra la polispermia.
Los folículos antrales tardíos, es decir, preovulatorios tienen otras producciones de carácter endocrino como las inhibinas y las activinas, las primera son hormonas de la familia peptídica que pueden controlar la liberación de la FSH inhibiendo la respuesta al GnRH. Están formada por dos cadenas de naturaleza peptídica unidas por enlaces de sulfuro, las cadenas han sido denominadas alfa y beta con las variantes A y B.
La combinación de dos cadenas Beta dan lugar a las activinas, las cuales constituyen el verdadero factor de liberación de la FSH, que durante muchos años fue buscado afanosamente a nivel hipotálamo y que Vale y Guillermin (1985) encontraron en las gónadas. Estas sustancias de carácter hormonal se han identificado disueltas en el líquido folicular de los folículos cavitarios de diferentes especies animales.
Actúan a nivel de la hipófisis donde se han demostrado receptores para las mismas. La adición de inhibinas a los cultivos de células de la pituitaria esta acompañada por 60-75% de disminución de la secreción de FSH; la dinámica de esta reacción es lenta. Bajo condiciones experimentales, similares, la secreción basal de LH no es modificada.
Dinámica folicular
El uso de la ecografía ha confirmado el modelo teórico Planteado por Rajakoski, quien propuso que los patrones de crecimiento y regresión folicular, a nivel individual y quién en total de la población, desarrollarán durante todo el ciclo pero no de forma continua sino muy relacionada en el momento o día de este.
Seguimiento ecográfico de los folículos durante todo el ciclo permite la descripción de los niveles de crecimiento y desarrollo foliculares. Así, folicular de la vaca puede enmarcar en las etapas de reclutamiento, selección y dominancia.
El reclutamiento folicular es el proceso por el qué, bajo la responsabilidad de la FSH, los folículos antrales pequeños (2-3 mm de diámetro) comienza a crecer, iniciando así una onda de desarrollo; grupos, más que folículos aislados, son reclutados y este proceso se relaciona, temporalmente, con cambio medibles de la FSH circulante. La aplicación antral es el medio preponderante del crecimiento del folículo durante este periodo, también hay evidencia de mitosis concomitante en las células de la granulosa complementarias, al menos en roedores.
Se han invocado factores intra ováricos estimulados por la FSH, lo que están involucrados en el proceso de reclutamiento folicular, los factores de crecimiento similar a la insulina (IGF-1) y las proteínas a las que estos se ligan han sido Implicados en la simplificación de la acción de la FSH. La IGF.1 potencializa el desarrollo del folículo, como un mitógeno, en Los folículos pequeños y por su acción en conjunto con las gonadotropinas para inducir la esteroidogénesis en los folículos antrales.
Los folículos desarrollan la fase desviación (comienzo de la diferenciación del crecimiento entre dos folículos grandes) y llegan a la dominancia de 4 días de la fase de selección partiendo de una coherente de +- 3 mm de diámetro, creciendo de un modo muy rápido.
Se ha podido observar que durante este periodo se produce un abrupto cambio en la concentración de FSH y en la pulsatilidad de la LH; este cambio hormonal puede actuar como el estímulo para el inicio de la diferenciación de los futuros folículos dominantes y los subordinados, estos cambios hormonales apoyan la hipótesis que expresan la necesidad de una cantidad suficiente de LH y concentraciones mínimas de FSH para que se facilite la desviación folicular.
El proceso de selección se caracteriza por el bloqueo ejercido por el folículo más desarrollado sobre los restantes folículos de la misma cohorte de desarrollo, este efecto se produce a través de sustancias hormonales como las inhibinas y el estradiol, las que actúan disminuyendo la liberación de FSH, de modo que los niveles insuficientes de gonadotropinas afectan, es en sicariocialmente, los folículos más pequeño, en esta fase existe un grupo reducido de folículos que escapan al proceso de atresia.
Otro mecanismo que se invoca es el de los factores paracrinos como el de la producción de factor de crecimiento epidermal (FCE) qué reduce la capacidad de los folículos pequeños para utilizar andrógeno.
La dominancia se refiere al desarrollo de un folículo mientras los restantes sufren un proceso de atresia fisiológica. El folículo dominante es más sensible a la acción de la gonadotropina que los restantes, por lo que a pesar de influir negativamente en la liberación de gonadotropinas FSH, no sufre Atresia, está la favorece también el IGF-1.
Se ha señalado que el primer folículo dominante pertenece a una cohorte de películas de 4-6 mm sea dos el primer día del ciclo (el día del celo como el día 0 del ciclo) para alcanzar su máximo tamaño (13-16 mm) entre los días 7-8, pudiendo permanecer estable hasta el día 11, momento en que inicia su regresión la que concluye el día 16.
El segundo folículo dominante puede ser ovulatorio o no, independencia de ciclos de 2 o 3 ondas de maduración, si el ciclo es de solamente 2 ondas, caminante aparece el día 11, mientras que si el siglo se caracteriza por 3 ondas, entonces aparecerá el día 8 para hacerse evidente el 3 folículo dominante, en este caso ovulatorio, el día 16 del ciclo.
En las vacas con 2 ondas de folículo dominante fue identificado el día 2,6 +- 0.7 adquiriendo su máximo desarrollo durante el día 8,7 con un tamaño de 16,7 +- 0,7 mm. La segunda onda fue detectada el día 15,3 +- 1,8 y su diámetro máximo de 18,7 +- 0,9 mm el día 22 +- 1.1. Cuando los animales presentaron tres ondas entonces la primera se identifico a los 2,2 +- 0,5, la segunda a los 11,0 +- 0,8 y la tercera a los 17,0 +- 0,4 días alcanzándose los diámetros máximos a los 7,4 +- 0,4, 15,0 +- 0,9 y 22,2 y 0,2 días, respectivamente.
La duración de los intervalos interestrales no evidencio diferencias apreciables. Contrariamente a lo que se ha encontrado en otros estudios.
El control endocrino del crecimiento y desarrollo de nuevos folículos es atribuido a la gonadotropina FSH, en el vacuno se ha descrito un incremento En los niveles de esta hormona cuando se cauterizan los folículos dominantes, así mismo, penetración de líquido folicular estimula la aparición de una cohorte de folículos con diámetro de 4 y 5 mm, lo que ocurre de 24 a 48 horas posteriores a la administración.
La competencia entre los folículos por la FSH circulante es la responsable de la dominancia; cuando se elimina el folículo dominante, subordinado más cercano al dominante ocupa su lugar.
La FSH es impensable para la secreción de estrógenos foliculares ya que estimula el crecimiento, la mitosis y la completa diferenciación de las células de la granulosa de los folículos preovulatorio grandes, para que adquieran receptores para la LH y desarrollen su máxima actividad aeromatizante. Cerca del 90% del estiércol secretada por los ovarios se deriva de los de estos folículos estimulados por la FSH.
La información de los folículos ováricos durante el ciclo estral en el ganado está regulada por las concentraciones de progesterona plasma actuando vía feedback negativo, lo que tiene un efecto en la secreción de LH.
La baja frecuencia de los pulsos de LH en la fase luteal que la caracteriza no es suficiente para mantener el continuo crecimiento de los folículos dominantes, por esta situación, por esta situación se ha formulado la hipótesis de que la inadecuada secreción de androgenos por la teca interna limita la subsecuente función de las células de la granulosa, necesaria para terminar el desarrollo y la función de los folículos dominantes, los cuales no pueden suprimir prolongadamente el crecimiento de otros folículos y por ello otra nueva onda de desarrollo folicular se inicia.
El papel de la FSH en la selección y dominancia ha sido demostrado por la administración de FSH exógena durante 2 días dentro del período en que se prevé la selección de un folículo, esta aplicación retrasa la esperada selección, alterando significativamente los perfiles de crecimiento del dominante y aumentando el crecimiento y retrasando la regresión del primero y segundo folículos subordinado.
Se ha propuesto que la disminución de la liberación de LH constituye el estímulo principal para el inicio del mecanismo de desviación manteniéndose niveles basales de LH que permiten solamente el crecimiento de los folículos dominantes. Los folículos que en el futuro serán dominantes concluyen la fase de selección con 8,5 mm y el folículo subordinado mas cercano solamente mide 7,8 mm.
En los últimos años se ha reportado que en los folículos dominantes y los subordinados de la primera onda de maduración están presentes proteínas que se combinan con la IGF, estas proteínas han sido designadas por números de modo tal que su presencia se identifica por los símbolos siguientes:
IGF BP-2,3, 4 y 5. Estos hallazgos apoyan la hipótesis que plantea que los folículos dominantes pueden emplear, de manera mas eficiente, los niveles existentes de FSH debido al aumento de la disponibilidad de los IGF y que la atresia en los folículos subordinados es el resultado de una reducción inducida por el IGF BP sobre los IGF.
Actualmente se sabe que la atresia folicular es un proceso que causa la muerte y desaparición de mas del 99% de los folículos que entran a la población de crecimiento. La mayoría de la degeneración folicular ocurre en el estadio antral temprano, antes del reclutamiento.
La atresia puede engendrar perdida de la vascularidad de la teca, degeneración del ovocito y picnosis de la granulosa, en un proceso de todo o nada. El medio mas común de la degeneración celular fisiológica es por apoptosis o muerte celular programada.
La apoptosis fue identificada como mecanismo de muerte celular programada en los folículos atresicos. Como se indico anteriormente, las gonadotropinas y los factores de crecimiento son elementos esenciales para el mantenimiento de la población folicular, entre sus efectos pleiotropicos esta la prevención de la apoptosis.
El efecto de las gonadotropinas puede ser directo, toda vez que la apoptosis puede suprimirse in vitro por tratamiento con agentes que minimizan las acciones de las gonadotropinas.
El proceso de atresia puede ser visto como una respuesta a la falta de gonadotropina. En la foliculogénesis bovina normal, esto ocurre en los folículos que no son reclutados y en los que son reclutados pero no llegan a ser dominantes debido al retrocontrol inhibitorio de la secreción de FSH por el folículo dominante. La atresia del folículo dominante ocurre por la falta del soporte de LH necesario para continuar su desarrollo hasta la ovulación.
De modo resumido se puede plantear que la primera onda de maduración se aprecia durante la primera semana posterior al celo, donde existe un folículo dominante que produce un pico de estrógeno los días 5 y 6 del ciclo, estos picos son de una magnitud discreta y se han relacionado con la vitalidad de los embriones en esa época y con la migración e implantación del mismo.
La segunda oleada de maduración ocurre durante la segunda semana del ciclo (10-15 días) relacionándose también con una descarga de estrógenos la cual esta asociada a la estimulación en la síntesis en el útero, de receptores bioactivos para la oxitocina, lo que en su momento desempeña un papel fundamental en la producción y liberación de prostaglandina.
Desde el punto de vista clínico la coincidencia de un folículo dominante con un cuerpo lúteo activo permite establecer el pronostico aproximado del próximo celo, por ende, reconocer si existe ciclo ovárico o si por el contrario estamos frente a un caso de anestro (aciclia).
La tercera onda de maduración solo se presenta en una proporción de animales y la misma ocurre desde el día 17 hasta el momento de la ovulación. Los folículos dominantes preovulatorios pueden localizarse en la segunda y tercera onda de maduración en dependencia del ritmo circadiano de cada hembra.
Ovulación
Se han propuesto diversos modelos teóricos relacionados con el proceso de la ovulación (ovocitación) desde lo más antiguos de tipo mecánico o físico, pasando por el enfoque endocrino-nervioso hasta los que dedican una atención preferencial a los procesos de tipo enzimático. A pesar de lo controvertido de los diferentes enfoques y tendencias, se han observado determinados pasos o eventos fisiológicos que pueden explicar lo esencial de este complejo proceso, lo que es posible resumir del modo siguiente.
- Aumento de la vascularización de toda la pared folicular, excepto en el ápice del mismo, donde se produce una zona a vascular, la que representa el lugar por donde se romperá el folículo.
- Disociación de las células de la granulosa, adelgazamiento notable del grosor de la pared folicular.
- Disociación también de la célula que conforman el Cumulus oopchurus liberándose el ovocito del macizo celular ovejero.
- La vascularización Folicular probatoria condicionan los cambios edematicos en la teca externa folicular y con ello lo afecta la cohesión celular de la misma. Participa además una fuerte acción enzimática (colágenas fundamentalmente) que destruye la elasticidad del folículo representada, principalmente, por la teca externa.
- En el apique del folículo, aparecen en las células epiteliales los lisosomas que con sus hidrolasas destruyen las células de la túnica albugínea y las de la teca folicular.
- La pared folicular se prolapsa cónicamente produciéndose determinados abombamientos, conocidos comúnmente como estigma de ovulación, lugar por donde se romperá la pared folicular.
Momentos antes de la ruptura folicular se aprecia una elevación en la concentración de las prostaglandinas y los estrógenos participando en la contracción ovárica y folicular, a causa de la cual se produce la expulsión del ovocito. En este momento participan también las enzimas que destruyen la cohesión de las fibras colágenas.
Se ha postulado que la descarga se ha postulado que la descarga de GnRH es necesaria para que se produzca la ovulación en todos los mamíferos; hasta hace algún tiempo nos había precisado que el modelo de la descarga de GnRH.
Era el determinístico o el permisivo, es decir, si la descarga preovulatoria de la LH dependía del incremento de la descarga de GnRH o si la descarga preovulatorio de LH y la ovulación dependía más de la sensibilidad de la hipófisis a la acción de GnRH que de la magnitud de la descarga de GnRH.
Recientemente se ha fundamentado el modelo determinístico de GnRH en la oveja a partir de los siguientes hechos: Primero, la gran descarga de GnRH aumenta junto con la descarga preovulatorio de LH, segundo, las fases foliculares aumentan la concentración del estradiol circulante y está descarga de GnRH se produce a causa del efecto positivo del feedback, tercero, el inicio de la descarga de LH requiere un incremento abrupto en el GnRH y en el mantenimiento de la descarga de LH necesita el continuo soporte de GnRH.
La inhibina y la folistatina son dos proteínas no relacionadas estructuralmente, que inhiben la secreción de FSH. La inhibina es un miembro de la familia de los factores de transformación y de crecimiento tipo b. Su estructura es hetero dinámica con sub-unidades alfa y Beta, las cuales existen en dos magnitudes de peso molecular en el líquido folicular bovino y ovino.
Las concentraciones de inhibina en el líquido folicular están reguladas por las gonadotropinas. La activina es el hemodimetro más importante de las subunidades Beta inhibina, la que incrementa, más que inhibe, la secreción de FSH. La folistatina es una proteína de enlace de alfa capacidad con baja afinidad por la activina, y es el único mecanismo conocido por el cual esta interfiere con la secreción de FSH.
En un modelo experimental se comprobó que los niveles de progesterona altos durante el periodo estral bloquean la liberación de LH con lo cual la duración del estro se prolonga, deprimiéndose las manifestaciones de este; así mismo se comprobó que la ovulación demoraba más que lo esperado, lo que influyo significativamente en la fertilidad.
De modo que hembras (novillas) que presentaron los niveles de progesterona suprabasales durante el estro, solamente se fecundaron en el orden del 46% mientras que las que presentaron niveles bajos de progesteronas (0,4-0,5 nmol/L) durante el celo mostraron una fertilidad mayor, es decir, se gestó el 90%.
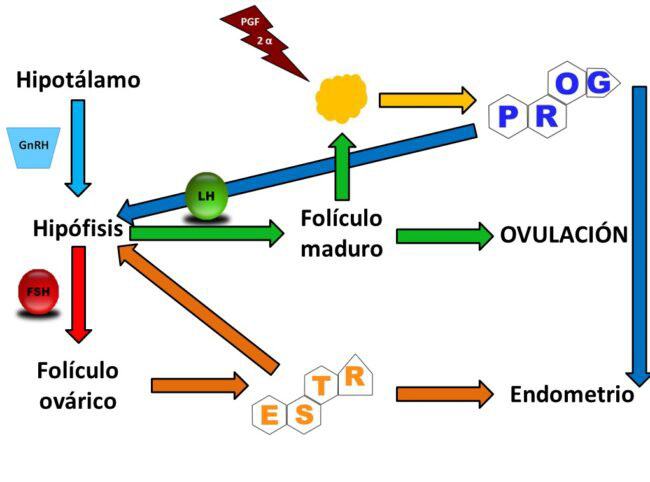
Cuerpo lúteo
Esta estructura funcional se desarrolla a partir de la cavidad folicular después de la ovulación, su desarrollo es sumamente rápido, de modo tal que durante la primera semana pos-ovulación puede ser palpado a través del examen rectal, su producción de progesterona es máxima desde el día 10 hasta el 16 del ciclo estral.
Aunque su nivel es importante ya desde el cuarto día del ciclo. La implantación y desarrollo del cuerpo lúteo (CL) aumenta considerablemente la circulación sanguínea del ovario, pues la misma puede pasar de 1 ml/min hasta 7 ml/min, lo que evidencia su intensa actividad hormonal en la producción de progestágenos que es su producto primario.
Aunque secreta además prostaglandinas y una variedad de hormonas peptídicas y proteicas como la rexina, oxitocina, vasopresina y estradiol en algunas especies El CL está constituido por las células de la teca interna (pequeñas y activas en la primera etapa de su desarrollo) y células de la granulosa (grandes y activas en la segunda mitad de su desarrollo).
Actualmente se supone que el mecanismo disparador para la producción de PG es el estrógeno, que permite la acción de la oxitocina hipofisiaria en el útero, posteriormente la oxitocina luteal establece una retroalimentación positiva con la PGF2a acelerándose la autolisis en la fase final del CL.
Sin embargo, este ciclo de retroalimentación se auto-limita debido a que los receptores para la oxitocina son destruidos después de ser utilizados, por lo que el útero deja de responder con liberación de PGF2a.
Está planteado que la síntesis de receptores para la oxitocina requiere de un tiempo aproximado de 6 horas, una vez que los mismos son utilizados, de modo tal que el patrón de secreción pulsátil de PGF2a se establece cada 6 horas, aproximadamente.
Se ha confirmado que durante el ciclo estral normal, la duración de la fase lútea depende, esencialmente, del momento en que la frecuencia de la liberación de PGF2a llegue a un pulso rítmico de 5 a 6 horas.
De forma similar, evidencias recientes han demostrado que un cuerpo lúteo de corta duración es intrínsecamente normal y que su corta vida está ocasionada, en realidad, por una programación prematura de la secreción pulsátil de prostaglandinas uterinas.
El ciclo estral se repite de modo ininterrumpido y de forma rítmica después de la pubertad, afectándose únicamente cuando se produce la fecundación y desarrollo de la gestación. Actualmente se conoce que el embrión es el responsable de indicar al útero su presencia para que éste responda suprimiendo el establecimiento del patrón de secreción pulsátil de PGF2a.
El embrión utiliza para ello un mensaje químico para lograr el reconocimiento materno de la gestación. En el caso de los rumiantes la sustancia producida por el embrión para llevar este mensaje al endometrio es una proteína trofoblástica denominada Proteína Trofoblástica Bovina 1 (bTP-1) la cual se produce con mayor abundancia, después de los 15 días de fecundación.
Esta proteína se combina con los receptores existentes en el endometrio bloqueando la liberación pulsátil de PGF2a. Es evidente que existe muy poco tiempo entre el momento en que el embrión puede señalar su presencia y el momento en que el útero materno está programado para destruir el cuerpo lúteo; esto explica que una causa importante de infertilidad en rumiantes es la regresión del CL antes que el embrión informe de su presencia.
Desarrollándose la asincronía materno embrionaria lo que se produce a causa de un retraso en el desarrollo embrionario o un adelanto en la liberación de PGF2a por parte del útero materno.