Como la colibacilosis aviar es una enfermedad muy crítica y con un gran impacto económico en la producción de pollos de engorde, invitamos a un experto en el tema para que responda las principales preguntas sobre el tema.
Con amplia experiencia en enfermedades aviares e infecciones causadas por enterobacterias, Dr. Terezinha Knöbl trabaja en el Laboratorio de Medicina Aviar del Departamento de Patología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidade de São Paulo (USP).
En la parte 1 de nuestra entrevista, ella proporcionó detalles sobre los problemas causados por las cepas patógenas de Escherichia coli (las APECs). Ahora, reservamos un espacio para aquellos que quieran profundizar más en el tema.
En este artículo, la Dra. Terezinha aborda cuestiones relacionadas con el potencial patogénico de las cepas de E. coli, marcadores de virulencia, genes de resistencia y habla sobre cómo aislar un APEC en el examen de rutina. ¡Mira la parte 2 de esta conversación!
1) Biocamp – ¿Cuáles son los marcadores de virulencia de una cepa de E. coli que nos dan pistas sobre su potencial patógeno?
Dra. Terezinha Knöbl – Existen varios protocolos para establecer el potencial de patogenicidad. Sin embargo, APEC es un patotipo muy diverso, con más de 25 marcadores distintos. El protocolo más utilizado para el diagnóstico de cepas virulentas es el de Johnson et al. (2008), quienes investigaron la presencia de 5 factores de virulencia considerados predictores mínimos:
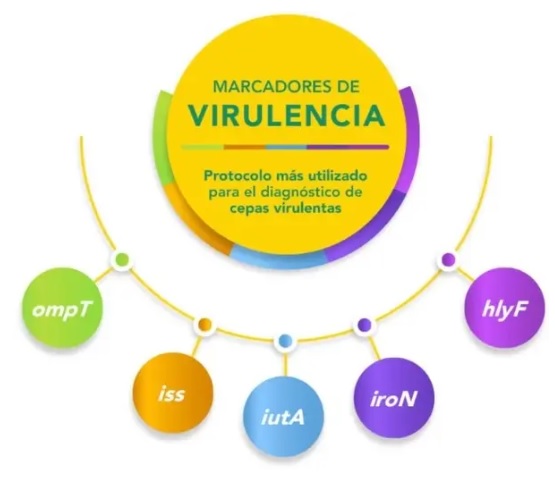
Además, los estudios que correlacionan la presencia y ausencia (por deleción) de genes de virulencia con patogenicidad en embriones o pollitos de 1 día de vida destacan la importancia de genes relacionados con la captura de hierro, la presencia del plásmido ColV, la adhesina termosensible tsh y la proteína iss (increased sérum survival). Algunos marcadores de virulencia relacionan APEC con otros patotipos de ExPEC, como los genes usp, papC y cnf (comunes en E. coli uropatógena) o sfa, ibeA y kps (presentes en E. coli asociada a meningitis). Estos marcadores sugieren el riesgo zoonótico de una cepa APEC.
2) Biocamp – Sabiendo que E. coli puede ser un contaminante de origen fecal de la muestra o un agente secundario, ¿cómo definir si APEC es el agente etiológico de un cuadro clínico?
Dra. Terezinha Knöbl – Algunos puntos son fundamentales para considerar un APEC como agente etiológico de un cuadro clínico. El aislamiento debe haberse realizado desde un sitio extraintestinal y en condiciones asépticas adecuadas. No puede haber evidencia de contaminación fecal en la recolección o transporte de la muestra. El ave debe tener lesiones sugestivas de colibacilosis. Por lo general, más de un ave con las mismas lesiones da como resultado el aislamiento del mismo agente.
Existen modelos fenotípicos que correlacionan la virulencia con la patogenicidad, pero estos modelos usan animales y, por razones éticas, solo deben usarse en situaciones específicas. Desde el punto de vista del diagnóstico molecular, debe considerarse como agente primario cuando el aislado presenta factores de virulencia APEC y pertenece al filogrupo G descrito por Clermont et al (2019). Los aislamientos pertenecientes a los filogrupos B2, D o F también suelen ser patógenos.
En casos de oportunismo, en los que cepas comensales actúan como agentes secundarios, los aislados se clasifican preferentemente en los grupos A o B1. Otras formas de clasificación incluyen la serotipificación, considerando que ciertos serogrupos, como O78, O2, O1 y O21, clásicamente se refieren a casos de colibacilosis aviar.
Más recientemente, la técnica MLST demostró ser útil en la identificación de secuencias dominantes en brotes de colibacilosis. Los aislamientos APEC tienen participación primaria cuando el linaje predominante pertenece al grupo formado por ST117, ST95, ST23, ST140 y ST428/429. Algunas otras ST también pueden afectar a las aves y se consideran potencialmente zoonóticas, como ST73, ST69 y ST131.
3) Biocamp – ¿Están asociados los genes de virulencia y resistencia en E. coli?
Dra. Terezinha Knöbl – Existe cierta limitación del tamaño del genoma bacteriano y, en el proceso evolutivo, las diferentes cepas tienden a acumular repertorios de virulencia o resistencia. Entonces, en términos generales, las bacterias muy virulentas tienden a ser menos resistentes y las bacterias muy resistentes tienden a ser menos virulentas. Pero hay excepciones.
Algunos elementos móviles como plásmidos e integrones pueden contener genes de virulencia y resistencia. Si existe una presión selectiva por los antimicrobianos y los genes de virulencia se encuentran en el mismo entorno genético, habrá coselección de bacterias virulentas y resistentes. Así que todo depende del entorno genético en el que se alojen estos determinantes de virulencia y resistencia.
4) Biocamp – ¿Qué hacer al aislar un APEC en un examen de rutina? ¿Justifica eso la aparición de alguna enfermedad? ¿Tiene sentido aislarlo de las heces o del tracto digestivo?
Dra. Terezinha Knöbl – En el caso del aislamiento APEC de rutina, es importante caracterizar el agente y monitorear los siguientes lotes. La interpretación de este hallazgo debe considerar el sitio de aislamiento, ya que APEC puede colonizar el intestino de las aves sin causar enfermedad entérica. El aislamiento de las heces no confirma el diagnóstico de colibacilosis, pero apunta a un riesgo de transmisión horizontal y vertical del agente. El riesgo dependerá en gran medida de la cepa aislada. El aislamiento de órganos como hígado, corazón, alvéolos, pulmón, senos paranasales, saco vitelino, folículos ováricos o médula ósea confirma el diagnóstico de colibacilosis (siempre que la recogida de muestra se haya realizado de forma rigurosa, libre de contaminación fecal). En este caso, si la ocurrencia no es puntual y los casos están asociados a impactos derivados de la mortalidad y el decomiso en la planta de faena, es necesario adoptar medidas de control más específicas.
5) Biocamp – Dado que E. coli es una bacteria que forma parte de la microbiota normal de aves sanas, ¿cuál es el significado del aislamiento de E. coli en el intestino de aves con problemas entéricos y respiratorios?
Dra. Terezinha Knöbl – En general, APEC tiene poca o ninguna participación en los procesos entéricos. Estos suelen estar más relacionados con procesos de disbiosis, en los que se produce un cambio cuantitativo entre distintas poblaciones bacterianas. En estos casos puede haber algún impacto en el desempeño zootécnico.
En los procesos respiratorios, las cepas de E. coli pueden actuar como agentes primarios u oportunistas de la enfermedad, dando como resultado aerosaculitis y/o sepsis. La participación primaria o secundaria depende del repertorio de virulencia. En general, APEC se considera el agente primario y las cepas comensales del filogrupo A o B1 son oportunistas.
En la parte 1 de la entrevista, Dra. Terezinha Knöbl enfatizó que los APEC no causan enfermedades entéricas: el repertorio de virulencia está asociado a infecciones sistémicas.
El cuadro principal es la enfermedad respiratoria (aerosaculitis) con posterior colonización del hígado y el corazón. Pero existe la posibilidad de sepsis, afecciones extraintestinales (onfalitis, ooforitis y salpingitis), celulitis, artritis y/o síndrome de la cabeza hinchada.
La diarrea aparece cuando hay disbiosis, es decir, cuando la microbiota del ave está desequilibrada. El uso de probióticos surge, entonces, como una alternativa eficaz para el control de APEC en la cadena productiva de pollos de engorde.
El mantenimiento de una microbiota intestinal en equilibrio es una de las principales estrategias para el control de patógenos. ¡Hable con uno de nuestros expertos para crear un programa de uso de los probióticos más adecuados para su negocio!
Autor/es: Dra Terezinha Knöbl




















